在肿瘤坏死因子信号转导中,RIP1的泛素化起到了早期细胞死亡检查点的作用,阻止了信号复合体从复合体-I到死亡诱导复合体-Ⅱ的空间转换。在这里,作者图片来源报道了Ankyrin重复结构域13a(ANKRD13a)作为复合物-II的一个新成分,为TNF的细胞毒潜力设定了更高的信号阈值。
已经证实,RIP1在K377位的多泛素化发生在复合体-I中,这在向复合体-II的转变过程中起着负向机制的作用。在这方面,ANKRD13a如何未能与泛素化的RIP1相互作用-K377 in Complex-I是一个在很大程度上仍未解决的问题。先前报道ABIN-1和NEMO(UBAN)的结合表面与Ub链有很高的亲和力。
鉴于UIM的这种固有的适度亲和力,有可能RIP1在Complex-I内的K377泛素化可能不足以与ANKRD13a结合。此外,可能需要RIP1连续泛素化的额外位点来与复合体-II中的ANKRD13a相互作用。有趣的是,据报道,RIP1可以在坏死小体中进行K115泛素化,从而稳定RIP1,从而有助于增敏其细胞毒性。
关于RIP1泛素化位点的功能后果,作者发现在RIP1缺陷细胞中,重组的RIP1K377/115R突变体而不是单个突变体(RIP1K115R或RIP1K377R)上调了TNF诱导的细胞毒作用。这些发现表明,RIP1的两个泛素化位点都需要调节复合体-II的形成,并提示ANKRD13a可能通过与泛素化的RIP1结合至少两个赖氨酸残基而被招募到复合体-II中。
然而,这项研究的结果也提出了几个有待解决的问题。由于很难从共表达系统中提纯ANKRD13a蛋白,我们无法用质谱分析K-GG肽与ANKRD13a结合的RIP1泛素化位点。需要进一步对泛素化事件进行蛋白质组学分析,以阐明在Complex-II从Complex-I空间转变过程中ANKRD13a与泛素化RIP1的动态相互作用。
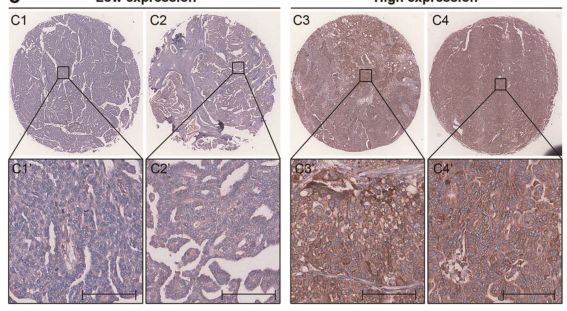
大量临床前和临床数据支持肿瘤坏死因子在肿瘤的发生和发展中起重要作用的概念,在炎症和癌变之间架起桥梁。此外,CIAP表达增强在几种癌症类型中也很常见,也被认为是卵巢上皮癌预后较差的指标。
因此,CIAP引起的RIP1泛素化可能与上调的ANKRD13a充分结合,从而使OV细胞逃避TNF介导的细胞毒作用。未来需要对ANKRD13a和RIP1相关基因进行综合网络分析,以阐明它们在某些类型癌症中的病理生理学相关性。
德瑞,SCI论文服务平台
德瑞隶属于广州德瑞信息科技有限公司旗下品牌,是一个专注于医学领域、SCI科研学术服务的互助平台,专业提供医学编译、SCI评估、SCI论文发表、翻译、润色、文献检索以及留学访学等服务,为研究学者及各类学术单位保驾护航,让广大科研工作者享受最优质的学术服务。

基于多年的行业积累,拥有涵盖医学、药学、法学、经济学等领域强大的专家团队以及丰富的信息资源数据库,建立了多学科、多语种、专业化的经历丰富的编校团队,凭借高效的资源整合、良好的沟通能力和务实的专业服务赢得了研究学者及各类学术单位的一致认可,在各学术领域的学者树立了良好的知名度和声誉,成长为国内医学科研学术服务行业的领航者。







