因此,发展体外、高效、标准化的方法向这些非模式肠道细菌中成功引入外源DNA,并且采用合适的基因编辑工具实现目标基因的编辑对于探索基因和宿主之间的关系而言至关重要。
美国康奈尔大学威尔康奈尔医学院郭春君团队(金文兵博士为第一作者)在 Cell 上在线发表了题为:Genetic manipulation of gut microbes enables single-gene interrogation in a complex microbiome 的研究论文。
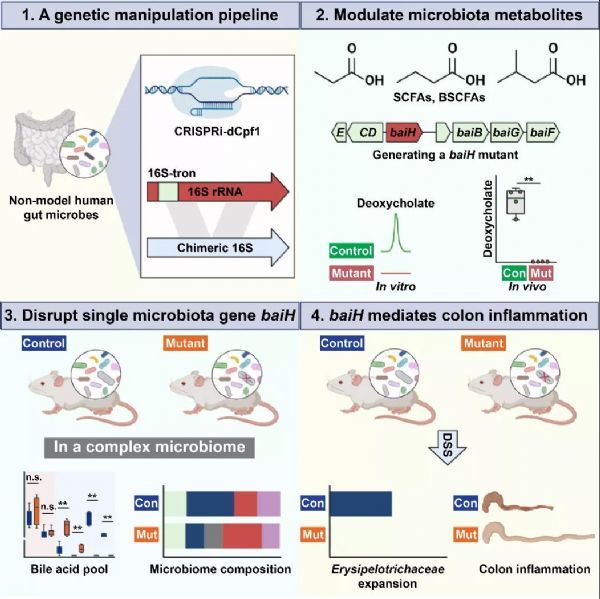
研究团队发展了一套开发针对非模式肠道细菌的基因编辑工具的方法, 成功筛选了向88株肠道细菌 (以梭菌纲和拟杆菌纲为主) 中引入外源DNA的方法,建立合适的基因编辑手段对其中的目标基因进行编辑并在体外和无菌小鼠体内两方面进行验证,进而实现了在复杂肠道菌群体系中,对具有重要生理意义的初级胆汁酸7位脱羟基途径中关键基因baiH影响宿主生理功能的机制的探索。
作者首先对200株实验菌株的固体/液体培养基进行了筛选,并确定了适合种类/浓度的抗生素。
对于梭菌纲菌株,作者在多个参数层面进行优化,包括增加候选origin of replication数量、优化抗性基因的启动子、尝试不同的接合转移供体、不同的供体菌/受体菌比例、接合转移时长、尝试不同引入质粒的方法(结合转移和电转化)等等,最终以41%的成功率确定了38株梭菌纲菌株的质粒引入方法。在此基础上,在菌株基因组信息未知的情况下,作者分别采用CRISPRi-dCpf1和Group II intron两种基因编辑的手段对所筛选出来可引入外源质粒的菌株的基因编辑可行性进行了验证。CRISPRi-dCpf1体系以所引入外源质粒上的lacZα作为报告基因,通过验证该报告基因在菌株中表达的抑制来确认菌株的可编辑性;Group II intron体系以菌株之间保守性很高的16S基因作为目标基因,通过验证对16S基因的插入突变来确认菌株的可编辑性。
对于拟杆菌纲菌株,由于其具有较高的同源重组效率,因此作者在多个参数条件优化之后,采用自杀型质粒,同样在菌株基因组信息未知的情况下,以菌株之间保守性很高的16S基因作为目标基因,通过验证对16S基因的单交换同源重组插入突变来同时确定菌株的外源质粒引入方法和可编辑性。
随后,在已知基因组信息的菌株中,作者对具体目标基因进行了编辑,实现了对bcat基因的表达的抑制,以及对丙酸、丁酸、异戊酸产生的敲除/抑制并进行了无菌小鼠体内验证。证明所开发出来的基因编辑工具针对具体基因仍然可行。
基于此,作者发现所筛选出来可基因编辑的菌株中有一株未报道过的菌株具有使初级胆汁酸(胆酸,鹅去氧胆酸)发生7位脱羟基化产生次级胆汁酸(脱氧胆酸,石胆酸)的活性,通过基因组测序找到对应的bai operon之后,敲除了7位脱羟基途径中的关键基因baiH,突变株在体外和无菌小鼠体内都丧失了7位脱羟基化的活性。
在此基础上,作者将获得的baiH敲除突变株定植于具有复杂菌群的SPF老鼠,发现baiH基因的敲除同样使SPF老鼠的肠道丧失了7位脱羟基化的活性,并且会显着影响小鼠肠道的胆汁酸分布以及菌群分布。在DSS结肠炎模型中,baiH敲除突变株定植的SPF老鼠相比于野生型菌株定植的SPF老鼠具有更好的抗炎症表现。
通过进一步研究,作者发现baiH敲除突变株相比野生型菌株定植的SPF老鼠具有更好抗炎症表现。其中的原因之一可能是baiH敲除突变株定植的SPF老鼠相比于野生型菌株的肠道中具有促炎作用的细菌Erysipelotrichaceae的丰度显着降低,并且根据所定植SPF老鼠肠道菌群16S测序结果构建了一个含有Erysipelotrichaceae和野生型菌株/baiH敲除突变株的小型菌群在无菌小鼠里面对这一推测进行了验证。
综上所述,作者筛选了一系列肠道细菌引入外源DNA的方法,建立了合适的基因编辑手段对其中的目标基因进行编辑并进行了体外和体内验证,并且成功将该方法用于探索初级胆汁酸7位脱羟基途径中关键基因baiH影响宿主生理功能的机制。该方法的建立将大大促进人们对肠道菌群基因和宿主之间相互作用的研究。
德瑞,SCI论文服务平台
德瑞隶属于广州德瑞信息科技有限公司旗下品牌,是一个专注于医学领域、SCI科研学术服务的互助平台,专业提供医学编译、SCI评估、SCI论文发表、翻译、润色、文献检索以及留学访学等服务,为研究学者及各类学术单位保驾护航,让广大科研工作者享受最优质的学术服务。

基于多年的行业积累,拥有涵盖医学、药学、法学、经济学等领域强大的专家团队以及丰富的信息资源数据库,建立了多学科、多语种、专业化的经历丰富的编校团队,凭借高效的资源整合、良好的沟通能力和务实的专业服务赢得了研究学者及各类学术单位的一致认可,在各学术领域的学者树立了良好的知名度和声誉,成长为国内医学科研学术服务行业的领航者。







